All’inizio del millennio, l’interferenza dell’RNA (RNAi) ha rivoluzionato la scoperta del ruolo e dell’espressione dei nostri geni
di Cristiana Ciofalo
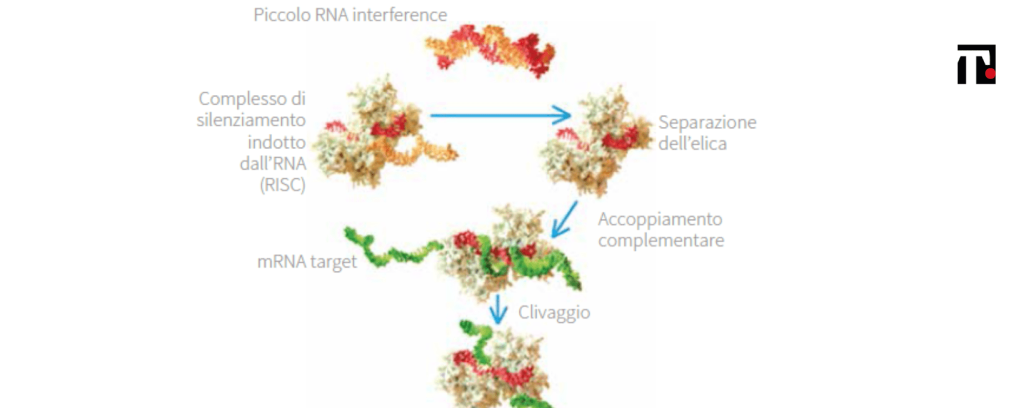
All’inizio del millennio, l’interferenza dell’RNA (RNAi) ha rivoluzionato la scoperta del ruolo e dell’espressione dei nostri geni. Il dogma centrale della biologia, secondo cui il DNA del nostro genoma codifica per l’RNA messaggero, il quale, a sua volta, viene tradotto in proteine, i principali elementi che costituiscono tutti gli organismi, è noto da tempo. Dopo innumerevoli tentativi di sequenziare il genoma di diversi organismi e il completamento del progetto del genoma umano, è iniziata la sfida volta a chiarire la funzione e la modalità di regolazione dei geni e la possibilità di tradurre queste conoscenze in un approccio terapeutico. Gli agenti terapeutici RNAi sono basati su siRNA (small interfering RNA) sintetici: si tratta di un acido nucleico che, una volta giunto nelle cellule, sfrutta un meccanismo naturale delle cellule umane per indurle a distruggere selettivamente l’mRNA codificante per una proteina nota per essere patogenetica, bloccandone la sintesi e, di conseguenza, controllandone la funzione o l’accumulo. Essendo basato sulla complementarità tra sequenze di nucleotidi, i siRNA agiscono con estrema selettività sulla sintesi della sole proteine target, senza interferire con il resto della fisiologia dell’organismo, limitando le interferenze con altri sistemi cellulari dovuti al legame non specifico di un farmaco convenzionale a proteine diverse da quella bersaglio. Inoltre, è applicabile a pressoché ogni proteina, indipendentemente dalla sua localizzazione nella cellula e dalla sua struttura. Napoli e Jorgensen sono stati i primi a descrivere il fenomeno dell’RNAinel 1990. Cercando di ottenere petunie di un colore viola intenso, si sono concentrati sull’enzima calcone sintasi, enzima chiave che avvia la biosintesi dei flavonoidi e, quindi, determina la colorazione viola nel mondo vegetale. Con loro grande sorpresa, nel tentativo di aumentare l’espressione della calcone sintasi con l’introduzione di un transgene, ottennero petunie bianche. Altri hanno descritto un fenomeno analogo in piante e animali negli anni successivi, ma non hanno saputo fornire una spiegazione esaustiva per le loro scoperte, e gli sperimentatori hanno iniziato a riconsiderare il dogma corrente.Nel 1998, Fire e Mello hanno pubblicato il fondamentale saggio, che è valso loro il Premio Nobel per la Fisiologia o la Medicina nel 2006, nel quale forniscono una spiegazione completa e dettagliata per il silenziamento dell’espressione di geni endogeni. Studiando il C elegans-verme nematode che presenta un numero ben definito (e costante) di cellule e che rappresenta un organismo ideale per lo studio del genoma – hanno dimostrato la necessità di un RNA omologo a doppio filamento (dsRNA – double strand RNA) per la degradazione dell’mRNA endogeno. L’assegnazione del Nobel già nel 2006, solo pochi anni dopo la scoperta del meccanismo, ha evidenziato l’importanza fondamentale della tecnologia della RNAi per la comunità scientifica, oltre che per i pazienti che necessitano di nuovi farmaci innovativi. La scoperta dell’RNAi è, infatti, stata spesso paragonata a quella della penicillina, tanto da rappresentare, oggi, una delle frontiere più promettenti e in rapido avanzamento nel campo della biologia e dello sviluppo dei farmaci innovativi. La scoperta che l’RNAi fosse un meccanismo attivo ed estremamente potente nelle cellule di mammifero, oltre al fatto che potesse essere attivato da dsRNA brevi sintetici chiamati siRNA, ha suscitato una fervente attività nel mondo della ricerca genica, fornendo ai ricercatori uno strumento ubiquitario per silenziare l’espressione di qualsiasi gene e comprenderne le funzioni implicate. Allo stesso tempo, la scoperta che l’RNAi è attiva in tutto il regno vegetale e animale apre all’ipotesi che l’RNAi possa essere utilizzata anche per trattare le malattie in un modo nuovo, completamente innovativo, andando a colpire l’mRNA delle proteine che causano la malattia.
Tutto ciò ha portato alla nascita di numerose aziende biofarmaceutiche, come Alnylam Pharmaceuticals nel 2002 e altre, che puntano a sfruttare questa “rivoluzione in biologia a vantaggio della salute dell’uomo”. Sedici anni sono stati dedicati da Alnylam alla ricerca specifica sui meccanismi di delivery del farmaco nell’organo e nella cellula target e nel 2018, la Food and Drug Administration (FDA) ha introdotto per la prima volta in medicina i farmaci basati sulla RNAi con l’approvazione di ONPATTRO (patisiran), un siRNA che agisce nel fegato, per il trattamento dell’amiloidosi da transtiretina ereditaria (hATTR) in pazienti con polineuropatia. L’approvazione del primo farmaco basato sulle tecnologia RNAi costituisce una nuova speranza per i pazienti affetti da patologie con urgenti esigenze non soddisfatte in campo medico e preannuncia l’inizio di una nuova era nel campo delle terapie basate sulla RNAi. Oggi, vari farmaci promettenti per il trattamento di malattie epatiche, oculari e renali sono oggetto di studi clinici di fase 1, 2 e 3, e per molti di questi saranno presto disponibili i primi risultati clinici. Nell’ultimo anno si è aperta la strada della ricerca su nuove possibili applicazioni a livello del sistema nervoso centrale (SNC), e nei prossimi due anni si prevede la presentazione di numerose domande di autorizzazione di nuovi farmaci sperimentali (Investigational New Drug, IND) per il SNC, un tessuto colpito da molte malattie con una reale necessità di nuovi approcci terapeutici.
La capacità delle terapie basate sulla tecnologia RNAi di mirare a qualsiasi gene o a target patologici precedentemente non trattabili farmacologicamente, fa sì che l’approccio terapeutico RNAi sia destinato a diventare una potenziale e concreta nuova speranza per i pazienti con urgenti necessità di nuovi farmaci innovativi in aree terapeutiche con bisogni insoddisfatti e ad avere un ruolo fondamentale nel futuro dello sviluppo dei medicinali nell’industria farmaceutica.
